A água (H2O, HOH) é a molécula mais abundante na superfície da Terra, cobrindo, somente em sua forma líquida, cerca de 71% desta, além de estar presente em abundância na atmosfera terrestre, como vapor, e nos polos, como gelo.
Está em equilíbrio dinâmico entre as fases líquida e gasosa nas condições ambientes de temperatura e pressão (21-23°C, 1 atm).
À temperatura ambiente, é um líquido fracamente azul, praticamente incolor, insípido e inodoro.
Muitas substâncias dissolvem-se na água e ela é comummente chamada “solvente universal”. Por isso, a água na natureza e em uso raramente é pura, e pode apresentar propriedades diferentes daquelas que são encontradas no laboratório. Entretanto, há muitos compostos que são essencialmente, se não completamente, insolúveis em água.
A água é a única substância comum encontrada em todas as três fases usuais da matéria; a saber, a fase líquida, a sólida e gasosa.
A água compõe cerca de 75% do corpo humano.
A quantidade de água existente no interior da Terra é calculada pelos Geólogos como sendo de cerca de 15 vezes a existente nos Oceanos, estando por isso 15 partes em cada 1 do ciclo da água de fora da nossa vista, excepto por radar, e por sismologia (medições por explosões controladas).
Ainda assim, a água, que é uma substância química composta por 2 elementos (quando pura, como vimos ela é um solvente de quase tudo) não cessa de nos surpreender pelas suas propriedades químicas e físicas.
Nas químicas, a água tem uma faceta até muito divertida, pois a sua molécula parece o desenho da cabeça do rato Mickey e, para os alunos não se esquecerem, ensina-se que quando estão a beber água estão a beber de facto cabecinhas de ratos. 🙂

Molécula da água
Terá o criador Walt Disney pago os correspondentes direitos de autor à água?

Mais a serio, peço que verifiquem as diferentes cargas eléctricas presentes numa “simples” molécula de água:

E ainda a sua disposição geométrica:
E isso leva-nos à sua investigação, mais propriamente às ligações curtas e longas entre a água e o elemento Carbono.
A água transforma-se numa estrutura previamente desconhecida entre um líquido e um vapor quando em contacto com as moléculas de álcool, contendo longas cadeias de hidrocarbonetos, de acordo com os investigadores da Universidade de Purdue. No entanto, junto das cadeias curtas oleosas a água fica mais como o gelo.
A água desempenha um enorme papel nos processos biológicos, do enovelamento de proteínas à formação da membrana, e pode ser que essa transformação seja útil duma maneira ainda não compreendida, disse Ben-Dor Amotz, o professor de química que liderou a pesquisa.
A equipa de pesquisa liderada por Ben-Amotz revelou que à medida que examinava álcoois com cadeias de carbono cada vez mais longos, a transformação ocorria a temperaturas cada vez mais baixas.
Quando em contacto com uma corrente de sete átomos de carbono de comprimento, a molécula de água tornou-se muito mais flexível e mais vaporizada, isto a uma temperatura de 60 graus Celsius, o que é a cerca de meio caminho entre os pontos de fusão e de ebulição.
“Para óleos com cadeias maiores do que 4 carbonos, ou cerca de um nanómetro de comprimento, vimos a água transformar-se numa estrutura completamente nova, à medida que a temperatura subia,” disse Ben-Amotz. “Se a tendência que vimos é verdade, então esta transformação poderia estar acontecendo à temperatura do corpo em torno de importantes moléculas fisiológicas como as proteínas e os fosfolípidios.”
A água responde com muita sensibilidade estrutural a pequenas mudanças, disse ainda. “A versatilidade da água é o que a torna tão especial”, e prosseguiu, “por exemplo, as superfícies das proteínas têm regiões oleosas e regiões carregadas, e a água altera-se para acomodar estes componentes tão diferentes e ainda tudo o que estiver de permeio. Estamos aprendendo mais sobre como faz ela isso exactamente.”. Os investigadores verificaram que as moléculas de água que interagem com o óleo formam sempre uma estrutura mais ordenada, do tipo do gelo, em temperaturas mais baixas, isto enquanto a maior parte da água se mantinha líquida. Esta estrutura parecida com o gelo, derrete-se quando as temperaturas aumentam, e nas moléculas mais longas, surge uma nova estrutura.
Um paper científico (artigo que para ser publicado se submete ao escrutínio por outros cientistas) com os detalhes desta pesquisa financiada pela National Science Foundation está publicado na edição actual da Nature e também surge em destaque num artigo de notícias e opiniões na mesma edição. Além de Ben-Amotz, os co-autores incluem o estudante de Purdue Joel Davis e os seus colegas pós-doutorados Kamil Gierszal e Ping Wang.
As observações da equipa rematam um debate com mais de 70 anos sobre a iteração do óleo e da água, com alguns estudos que sugerem que a água forma pequenos icebergues em torno das moléculas de óleo, enquanto outros apontam para uma estrutura mais desordenada da água, esta última mais parecida com a dum vapor.
“Esta questão estava realmente em aberto até nós introduzirmos um método experimental que poderia ver essas mudanças subtis na estrutura de água,” disse Ben-Amotz. “Surpreendentemente, verificou-se que ambos os modelos estão correctos, e que dependem do tamanho do óleo.”
O desafio da experiência foi a de que a equipa precisava de ver um número muito reduzido de moléculas de água que se encontravam em contacto com as cadeias de óleo, examinando-as na presença de um grande número doutras moléculas de água.
A equipe combinou a dispersão Raman com a resolução de curva multi-variada para criar um método de análise capaz de gerir uma relação sinal-para-ruído sem precedentes de 10.000 para 1.
“A maioria das pessoas nunca teria um espectro com uma relação sinal-ruído maior do que 100-para-1, mas, se realizássemos esta experiência com esse procedimento nós não iríamos ver nada,” declarou Ben-Amotz. “Precisávamos de ter uma maior relação sinal-ruído, porque estávamos procurando uma agulha num palheiro com o tamanho duma montanha.”
A Espectroscopia com o efeito Raman envolve disparar um feixe de luz em fotões numa amostra. Quando os fotões atingem as moléculas da amostra, perdem ou ganham energia. Tais medições criam um espectro de picos que revelam os movimentos vibratórios das moléculas presentes na amostra. Logo mudanças nas formas dos picos “podem mostrar alterações na força das ligações entre moléculas de água e se estas moléculas estão-se tornando mais ou menos ordenadas.”
“Com a dispersão Raman a maior parte da água cria um pico montanhoso no espectro que enterra tudo,” disse Ben-Amotz. “A resolução de curva multi-variada permite-nos ver pequenas alterações na estrutura da água sob a montanha. Como é frequente em Ciência, a chave foi a combinação de duas técnicas já estabelecidas para abrir um novo caminho.”
Davis disse que a equipe planeia explorar os efeitos das mudanças no pH e nas cargas iónicas desta transformação com o objectivo de tornar as experiências mais relevantes para as proteínas e para os sistemas biológicos.
“Estamos tentando entender melhor as forças motrizes do comportamento das proteínas e das membranas celulares que são fundamentais para a nossa saúde”, disse ele. “O papel da água é uma peça importante do quebra-cabeças.”









4 comentários
Passar directamente para o formulário dos comentários,
Apenas Cavalcanti, Manel. 😉
Verificarei este documentário. 😉
Obrigado e abraços amistosos.
Upps, Bruno Cavalcanti, entusiasmei-me por causa das descobertas que te mencionei e quase me esquecia de agradecer o teu excelente comentário, com sólidas bases históricas, que tenho como uma excelente abordagem dum qualquer objecto, neste caso da água. :))
Olá Bruno, sempre em grande forma:))
Não vou colocar o link aqui por se tratar dum caso obviamente com imagens muito complicadas. Mas indico-te que a BBc publicou recentemente no seus documentários sobre investigações de desastres aéreos que uma dessas investigações revelou ter-se descoberto um novo tipo de gelo que mantém a água na fase líquida no seu interior, tendo apenas uma pequana película de gelo no exterior. Declara-se em altitudes de cerca de 9 quilómetros e a cerca de -50º Celsius.
Provocou um desatre muito grave sem sobreviventes num avião novo e com um registo de manutenção impecável, que previa a substituição dum sensor (que foi afectado por esse tipo de gelo) no mês seguinte.
Uma vez verificada a causa todos os aviões foram imediatamente equipados com novos sensores também preparados para esse tipo de gelo raro )no entanto já muito incidentes tinham sido evitados porque eram camadas muito pequenas, e os aviões tiverm tempo de recuperar, neste caso não, por ter sido uma canada inusitadamente grande, como se verificou depois nas leituras de radar do CDR – Cocpit data recorder.
Trata-se do desastre da ligação Rio de Janeiro-Paris, mas deixo o aviso que o documentário é emocionalmente muito difícil de ver.
Uma coisa no entanto valeu bem a pena, a Ciência descobriu esta causa de acidentes e pelo menos esta causa está evitada, continuando o avião a ser o meio de transporte mais seguro do mundo.
Um dos peritos explica até que há mais desastres de automóvel nos percursos até aos aeroportos do que nos aviões, que há um risco muito maior nesse simples percurso.
Esta descoberta das ligações com o carbono pode muito bem levar a novas ligas para pneus ( e a misturas de ar mais adequadas para os encher do que o ar ambiente, como por exemplo o nitrogênio, ou azoto como dizemos aqui).
O Químico que liderou a equipa antevê mais aplicações na saúde, mas também é legítimo antevermos inovações nos procedimentos industriais, e até mesmo um dia nas aplicações do quotidiano.
Por simples intuição, este tipo de descobertas, pouco ruidosas mas fulcrais, são as que fazem mudar o mundo, como numa revolução silenciosa mas eficaz. Penso que está aqui muito em jogo, afinal a água é a substância mais abundante em…nós.
Abraço. :))
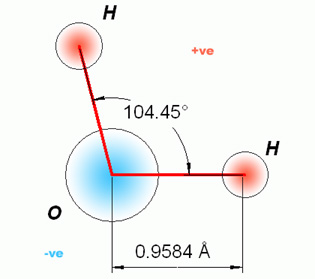
A água é uma substância polar, ou seja, o seu vetor momento dipolo é diferente de 0. Quando este vetor é maior que 1,7, a atração que um dos átomos constituintes da molécula sobre o par eletrônico é tão intensa que acaba por se tratar de uma ligação iônica (por curiosidade, a molécula de água, HOH, possui um vetor momento dipolo no valor de 1,84 D – pontes de hidrogênio). Observada tridimensionalmente, a molécula de água é explicada pela teoria da repulsão dos pares eletrônicos da camada de valência (VSEPR) proposta pelo cientista britânico Ronald Gillespie: tem formato em “V” e forma angular (o ângulo alfa formado entre os hidrogênios é 104,45º – ou aproximadamente 105º, de acordo com alguns livros da literatura vigente).
Um excelente artigo, Manel! 🙂 Devidamente linkado aos meus favoritos. 😉
Abraços.